As imagens mais nítidas de bactérias vivas já foram registradas por pesquisadores da UCL, revelando a arquitetura complexa da camada protetora que envolve muitas bactérias e torna-as mais difíceis de serem mortas por antibióticos.
Pela University College London publicado por Phys.
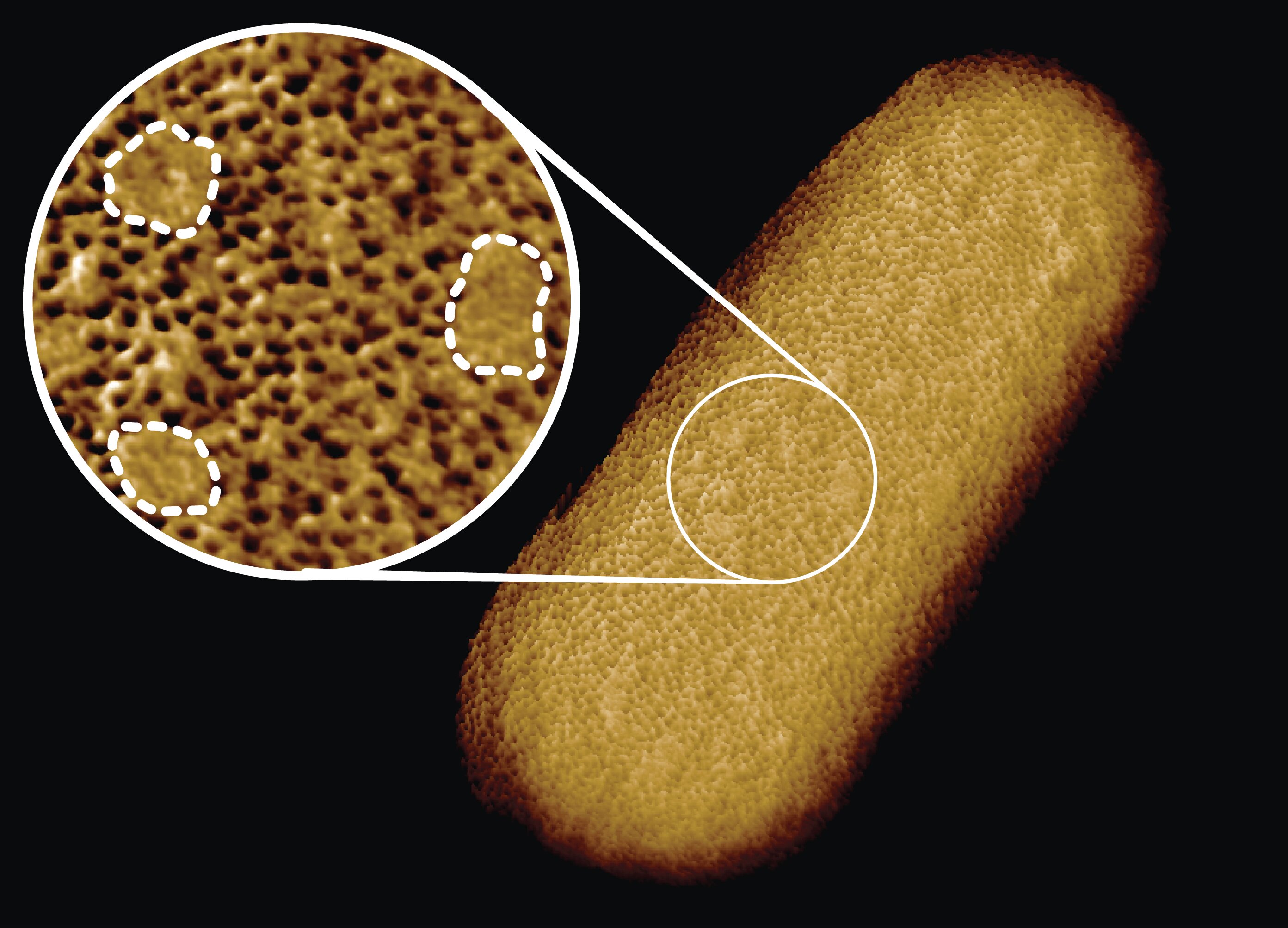
O estudo, publicado em Proceedings of the National Academy of Sciences e feito em colaboração com cientistas do National Physical Laboratory, King’s College London, University of Oxford e Princeton University, revela que bactérias com camadas externas protetoras – chamadas bactérias Gram-negativas – podem têm pontos mais fortes e mais fracos em sua superfície.
A equipe descobriu que a membrana externa protetora da bactéria contém densas redes de blocos de construção de proteínas alternadas por manchas que não parecem conter proteínas. Em vez disso, esses adesivos são enriquecidos em moléculas com cadeias açucaradas (glicolipídios) que mantêm a membrana externa firme.
Esta é uma descoberta importante porque a membrana externa resistente das bactérias Gram-negativas impede que certos medicamentos e antibióticos penetrem na célula: esta membrana externa é parte da razão pela qual a resistência antimicrobiana de tais bactérias (incluindo A. baumannii , P. aeruginosa e Enterobacteriaceae, como Salmonella e E. coli ) é agora considerada uma ameaça maior do que a de bactérias Gram-positivas, como S. aureus resistente (bem conhecido como MRSA).
“A membrana externa é uma barreira formidável contra os antibióticos e é um fator importante para tornar as bactérias infecciosas resistentes ao tratamento médico. No entanto, permanece relativamente incerto como essa barreira é montada, razão pela qual optamos por estudá-la com tantos detalhes”. explicou o autor correspondente, Professor Bart Hoogenboom (London Centre for Nanotechnology at UCL e UCL Physics & Astronomy).
“Ao estudar bactérias vivas da escala molecular à celular, podemos ver como as proteínas da membrana formam uma rede que se estende por toda a superfície da bactéria, deixando pequenas lacunas para manchas que não contêm proteínas. Isso sugere que a barreira pode não ser igualmente dura para romper ou esticar toda a bactéria, mas pode ter pontos mais fortes e mais fracos que também podem ser alvo de antibióticos. “
Para entender melhor essa arquitetura, os cientistas aplicaram uma agulha minúscula sobre a bactéria Escherichia coli ( E. coli ) viva , “sentindo” assim sua forma geral. Como a ponta da agulha tem apenas alguns nanômetros de largura, isso possibilitou a visualização de estruturas moleculares na superfície bacteriana.
As imagens resultantes mostram que toda a membrana externa da bactéria está repleta de buracos microscópicos formados por proteínas que permitem a entrada de nutrientes ao mesmo tempo em que evitam a entrada de toxinas. Embora a membrana externa fosse conhecida por conter muitas proteínas, essa natureza aglomerada e imóvel fora inesperada.
Surpreendentemente, as imagens também revelaram muitas manchas que não pareciam conter proteínas. Essas manchas contêm um glicolipídeo normalmente encontrado na superfície de bactérias Gram-negativas. Além disso, um tipo diferente de remendo semelhante a uma espinha se formou quando partes da membrana foram viradas do avesso devido a mutações. Nesse caso, o aparecimento desses defeitos se correlacionou com o aumento da sensibilidade à bacitracina, um antibiótico geralmente eficaz apenas contra bactérias Gram-positivas, mas não contra bactérias Gram-negativas.
Conforme explicado por Georgina Benn, que fez a microscopia da bactéria no laboratório do Professor Hoogenboom na UCL: “A imagem de livro da membrana externa bacteriana mostra proteínas distribuídas sobre a membrana de uma forma desordenada, bem misturadas com outros blocos de construção da membrana . Nossas imagens demonstram que não é o caso, mas que as manchas lipídicas são segregadas das redes ricas em proteínas, assim como o óleo se separa da água, em alguns casos formando fendas na armadura da bactéria. Esta nova maneira de olhar para a membrana externa significa que agora podemos começar a explorar se e como essa ordem é importante para a função da membrana, integridade e resistência aos antibióticos. “
A equipe também especula que as descobertas podem ajudar a explicar as maneiras pelas quais as bactérias podem manter uma barreira protetora compacta e, ao mesmo tempo, permitir um crescimento rápido: a bactéria comum E. coli dobra de tamanho e se divide em 20 minutos em condições favoráveis. Eles sugerem que os adesivos de glicolipídeo podem permitir um maior estiramento da membrana do que as redes de proteínas, tornando mais fácil para a membrana se adaptar ao tamanho crescente da bactéria.
Mais informações: Phase separation in the outer membrane of Escherichia coli, Proceedings of the National Academy of Sciences (2021). www.pnas.org/cgi/doi/10.1073/pnas.2112237118










